Đề tài: Nghiên cứu bào chế thực phẩm chức năng RegluBG có tác dụng hạ đường huyết, nhuận tràng bổ huyết từ cây Địa hoàng (Rehmannia glutinosa (Gaertn.) Libosch.) trồng ở Bắc Giang
Đề tài: Nghiên cứu bào chế thực phẩm chức năng RegluBG có tác dụng hạ đường huyết, nhuận tràng bổ huyết từ cây Địa hoàng (Rehmannia glutinosa (Gaertn.) Libosch.) trồng ở Bắc Giang.
a) Tên đề tài: Nghiên cứu bào chế thực phẩm chức năng RegluBG có tác dụng hạ đường huyết, nhuận tràng bổ huyết từ cây Địa hoàng (Rehmannia glutinosa (Gaertn.) Libosch.) trồng ở Bắc Giang.
b) Cơ quan chủ trì: Công ty Cổ phần Dược phẩm Bắc Giang
c) Chủ nhiệm đề tài: TS. Nguyễn Văn Sinh
d) Mục tiêu của đề tài
Đ) Kết quả thực hiện đề tài
1. KIỂM ĐỊNH CHẤT LƯỢNG NGUYÊN LIỆU ĐẦU VÀO
Bảng 1: Kết quả kiểm định chất lượng sinh địa
|
TT |
Chỉ tiêu |
Yêu cầu cần phải đạt được |
Kết quả |
|
1 |
Mô tả |
Củ khô hình dạng không đều hoặc hình thuôn, khoảng giữa phình to, hai đầu hơi nhỏ, dài 3cm đến 8cm, đường kính 0,2 cm đến 1,5 cm. Loại củ nhỏ hình dải hơi dẹt, cong queo hoặc xoắn lại, mặt ngoài màu nâu đen hoặc xám nâu, nhăn nheo nhiều, có các đường vân lượn cong nằm ngang không đều. Thể nặng, chất tương đối cứng, dai, khó bẻ gãy. Mặt bẻ màu nâu đen bóng, dính, mùi thơm nhẹ, vị hơi ngọt. |
Đạt |
|
2 |
Vi phẫu |
Mặt cắt ngang phần rễ thấy có lớp bần gồm nhiều hàng tế bào hình nhiều cạnh. Mô mềm bao gồm các tế bào có thành mỏng, có tế bào tiết nằm rải rác ở các mô đôi khi cũng bắt gặp trong libe. Libe-gỗ phát triển khá mạnh. Mạch dây gần tầng sinh libe-gỗ. Tầng sinh libe-gỗ xếp thành vòng liên tục. Gỗ cấp hai chạy vào đến tâm gồm những bó gỗ thưa và phân cách bởi tia ruột rộng gồm nhiều hàng tế bào. Tế bào ruột hình gần tròn, thành mỏng và kích thước không đều nhau. |
Đúng |
|
3 |
Soi bột |
Bột mầu nâu thẫm, mùi thơm và có vị hơi ngọt đắng. Soi dưới kính hiển vi thấy: Mảnh bần mầu nâu nhạt, nhìn từ mặt bên gồm các tế bào hình chữ nhật xếp đều đặn. Tế bào mô mềm hình gần tròn. Tế bào tiết chứa giọt dầu mầu vàng cam hay đỏ cam. Mạch mạng có đường kính từ 60-90 µm. |
Đúng |
|
4 |
Độ ẩm |
Không quá 15,0% |
Đạt |
|
5 |
Tro toàn phần |
Không quá 5,0% |
Đạt |
|
6 |
Giới hạn kim loại nặng |
Asen không quá 02 ppm sản phẩm khô kiệt. Chì không quá 10 ppm sản phẩm khô kiệt |
Đạt |
|
7 |
Tạp chất |
Tạp chất khác không quá 1,0% |
Đạt |
|
8 |
Định tính nhóm iridoid glycosid; catalpol bằng sắc ký lớp mỏng |
Sử dụng chuẩn là chất chuẩn catalpol và dược liệu chuẩn Can Địa hoàng: Phải có phản ứng đặc trưng của Iridoid glycosid, catalpol |
Đúng |
|
9 |
Định lượng Catalpol |
Hàm lượng catalpol trong dược liệu Can Địa hoàng không được thấp hơn 0,2% tính theo dược liệu khô kiệt |
Đạt |
2. KẾT QUẢ QUY TRÌNH ĐIỀU CHẾ CAO LỎNG DỰA VÀO PHƯƠNG PHÁP CHIẾT NÓNG THƯỜNG QUY VỚI DUNG MÔI LÀ NƯỚC THEO HAI GIAI ĐOẠN
2.1. Kết quả nghiên cứu quy trình chiết xuất và loại tạp
Kết quả nghiên cứu về thành phẩm như sau: Cao lỏng Sinh địa (1:1) có các đặc điểm nhận biết được mô tả: Chất lỏng sánh, màu nâu đen, có mùi thơm đặc trưng của dược liệu. Nghiên cứu được tiến hành khảo sát từ 4 yếu tố ảnh hưởng như: kích thước tiểu phân dược liệu; Dung môi chiết xuất/dược liệu; Thời gian chiết tới hiệu suất chiết; số lần chiết. Khảo sát các yếu tố ảnh hưởng tới chiết xuất cụ thể là: (1) Kích thước tiểu phân: Sinh địa thái lát 2 mm; cắt đôi. (2) tỉ lệ dược liệu/dung môi trong mỗi lần chiết là 1:6; 1:7. (3) Thời gian chiết tới hiệu suất chiết: Tính từ khi sôi đến lúc chiết 1h; 1,5h; 2h. (4) Số lần chiết: 2 lần; 3 lần.
2.2. Kết quả nghiên cứu quy trình cô cao
Toàn bộ khối lượng dịch chiết thu được sau khi loại tạp, đưa vào thiết bị chiết xuất, cô bằng nồi hấp 2 vỏ, nhiệt độ 60-700C. Cô dịch chiết tới tỷ lệ 1:1 (1g dược liệu: lml cao lỏng).
Nhóm nghiên cứu nhận thấy, Mẫu M22 có hàm lượng catalpol cao nhất (0,257%) nên chúng tôi chọn quy trình điều chế cao lỏng Sinh địa theo các thông số cụ thể như sau:
(1) Kích thước tiểu phân dược liệu: Thái lát 2 mm.
(2) Tỷ lệ dược liệu/dung môi trong mỗi lần chiết xuất: 1:6; 1:7.
(3) Thời gian chiết tới hiệu suất chiết: 2 giờ kể từ khi sôi.
(4) Số lần chiết: 3 lần.
3. KẾT QUẢ QUY TRÌNH ĐIỀU CHẾ CAO KHÔ DƯỢC LIỆU DỰA VÀO PHƯƠNG PHÁP PHUN SẤY Ở QUY MÔ PHÒNG THÍ NGHIỆM
Điều chế được cao khô Sinh địa bằng phương pháp phun sấy ở quy mô phòng thí nghiệm. Quá trình sản xuất thành phẩm được thực hiện đúng qui định ghi trong qui trình sản xuất gốc được sản xuất tại Học viện quân y.
Kết quả nghiên cứu về đặc điểm thành phẩm của sản phẩm bột cao khô Sinh địa được mô tả như sau: Bột cao khô Sinh địa khô tơi, màu vàng, không có nấm mốc, mùi thơm đặc trưng của dược liệu, vị ngọt, dễ hút ẩm ngoài không khí.
4. KẾT QUẢ CÔNG THỨC VÀ QUY TRÌNH BÀO CHẾ VIÊN NANG CỨNG REGLUBG Ở QUY MÔ PHÒNG THÍ NGHIỆM
4.1. Xây dựng công thức bào chế viên nang cứng RegluBG
Theo qui định trong sản xuất viên nang yêu cầu thực phẩm chức năng chứa trong nang thường ở dạng rắn (bột, cốm, pellet,...). Quá trình chế tạo vỏ nang và đóng thực phẩm chức năng được thực hiện riêng [2], [5]. Đối với bột thực phẩm chức năng đóng nang cần thêm tá dược, bao gồm tá dược độn, tá dược trơn, chất gây thấm [2], [3], [5], [6].
Trong quá trình xây dựng công thức bào chế đã tiền hành qua các bước sau: Chuẩn bị nguyên liệu, dụng cụ và thiết bị đạt tiêu chuẩn theo DĐVN IV, dụng cụ phải sạch. Trộn bột kép: Trộn bột dược chất với tá dược chống hút ẩm. Trộn bột với tá dược còn lại theo nguyên tắc đồng lượng (tá dược trơn cho sau cùng). Sát bột qua rây 0,315 mm để đồng nhất khối bột. Đóng khối bột vào nang trên máy đóng nang thủ công. Làm sạch nang. Lựa chọn các nang đạt tiêu chuẩn. Đóng nang thuốc vào lọ. Dán nhãn, bảo quản dưới 300C, nơi khô mát, tránh ánh sáng trực tiếp.
Đã xác định khối lượng các thành phần viên nang. Thiết kế công thức khảo sát tá dược được trình bày ở bảng sau.
Bảng 9: Thành phần dược chất, tá dược trong các công thức khảo sát
|
Thành phần |
Khối lượng thành phần khảo sát (mg) | |||||||
|
CT1 |
CT2 |
CT3 |
CT4 |
CT5 |
CT6 |
CT7 |
CT8 | |
|
Bột cao khô Sinh địa |
400 (tương đương 1,82 mg Catalpol) | |||||||
|
Natri Starch glycolat |
0 |
10 |
20 |
30 |
20 |
20 |
30 |
30 |
|
Aerosil |
5 |
5 |
5 |
5 |
10 |
15 |
10 |
0 |
|
Magnesi stearat |
5 | |||||||
|
Lactose |
Vừa đủ nang số 0 | |||||||
Quá trình nghiên cứu tá dược để khảo sát công thức, bao gồm:
Tá dược siêu rã: Natri Starch glycolat từ 0-30 mg/viên, mục đích cho vào làm cho viên rã nhanh.
Tá dược trơn chảy và chống hút ẩm: Aerosil từ 0-15 mg/viên, có tác dụng hạn chế sự hút ẩm trong quá trình bào chế, bảo quản và tác dụng tăng khả năng trơn chảy, chống dính của khối bột đóng nang.
Tá dược trơn: Là Magnesi stearat với khối lượng là 5 mg/viên, có tác dụng điều hòa sự trơn chảy của khối bột khi đóng nang để đảm bảo độ đồng đều về khối lượng cũng như là hàm lượng của dược chất trong mỗi viên nang.
Tá dược độn: Được dùng khi lượng dược chất thấp không chiếm đủ dung tích nang, trong khảo sát chúng tôi dùng lactose phun sấy có ưu điểm là kích thước tiểu phân đồng đều, ít hút ẩm, trơn chảy tốt.
Từ các công thức của bảng trên, nhóm nghiên cứu đã tiến hành đo tỷ trọng biểu kiến của bột cao khô sinh địa, hỗn hợp bột tá dược (Natri Starch glycolat, Aerosil, Magnesi stearat) và của tá dược độ (Lactose phun sấy). Kết quả thể hiện ở bảng sau:
Bảng 10: Kết quả xác định tỷ trọng của thành phần đóng nang
|
Thành phần |
Tỷ trọng biểu kiến (g/ml) | |||||||
|
CT1 |
CT2 |
CT3 |
CT4 |
CT5 |
CT6 |
CT7 |
CT8 | |
|
Bột cao khô Sinh địa |
0,65 | |||||||
|
Hỗn hợp tá dược: Natri Starch glycolat, Aerosil, Magnesi stearat |
0,39 |
0,57 |
0,64 |
0,70 |
0,60 |
0,55 |
0,65 |
0,80 |
|
Lactose phun sấy |
0,74 | |||||||
Từ kết quả bảng trên cho thấy:
Tỷ trọng của bột cao khô Sinh địa là 0,65g/ml; còn tỷ trọng của lactose phun sấy là 0,74g/ml; tỷ trọng của hỗn hợp tá dược natri starch glycolat, aerosil, magnesi stearat thay đổi theo xu hướng càng tăng tỷ lệ Natri starch glycolat và giảm tỷ lệ aerosil thì càng làm tăng tỷ trọng của hỗn hợp bột này.
Kết quả xác định khối lượng lactose phun sấy thêm vào thể hiện ở bảng sau.
Bảng 11: Thành phần công thức khảo sát bào chế viên nang
|
Thành phần |
Khối lượng các thành phần công thức (mg) | |||||||
|
CT1 |
CT2 |
CT3 |
CT4 |
CT5 |
CT6 |
CT7 |
CT8 | |
|
Bột cao khô Sinh địa |
400 (tương đương 1,82 mg Catalpol) | |||||||
|
Natri Starch glycolat |
0 |
10 |
20 |
30 |
20 |
20 |
30 |
30 |
|
Aerosil |
5 |
5 |
5 |
5 |
10 |
15 |
10 |
0 |
|
Magnesi stearat |
5 | |||||||
|
Lactose phun sấy |
59,92 |
52,93 |
44,21 |
36,61 |
35,73 |
25,08 |
27,67 |
46,52 |
|
Khối lượng bột đóng nang |
469,92 |
472,93 |
474,21 |
476,61 |
470,73 |
465,08 |
472,67 |
481,52 |
Từ các công thức trên, xác định số lượng viên cần bào chế và tiến hành bào chế từng công thức, sau đó khảo sát ảnh hưởng của thành phần công thức đến độ rã, độ ẩm, từ đó lựa chọn được công thức tốt nhất để bào chế viên nang RegluBG.
* Kết quả ảnh hưởng của thành phần công thức đến độ rã của viên
Từ các công thức khảo sát trên, nhóm nghiên cứu tiến hành xác định độ rã của viên, kết quả được thể hiện ở bảng sau:
Bảng 12: Kết quả đo độ rã của các công thức khảo sát
|
Thông số |
Độ rã của viên ở các công thức khác nhau, n=6 | |||||||
|
CT1 |
CT2 |
CT3 |
CT4 |
CT5 |
CT6 |
CT7 |
CT8 | |
|
Độ rã (phút) TB ± SD |
7,8 ± 0,13 |
6,5 ± 0,25 |
4,7 ± 0,22 |
4,3 ± 0,28 |
4,8 ± 0,20 |
4,9 ± 0,21 |
4,4 ± 0,19 |
4,6 ± 0,25 |
|
P |
P1,2-3,4,5,6,7,8<0,05, p3,4,5-6,7,8>0,05 | |||||||
Từ kết quả ở bảng trên cho thấy:
Với cùng điều kiện là chất lượng vỏ nang giống nhau thì độ rã của viên nang bị ảnh hưởng nhiều nhất đến tỷ lệ tá dược rã (Natri starch glycolat) trong viên. Ở công thức CT1 khi không cho tá dược rã thì thời gian rã của viên là lớn nhất là 7,8 phút, nhưng khi cho thêm tá dược rã với lượng là 10mg/viên thì thời gian rã của viên giảm xuống còn 6,5 phút.
Khi sử dụng lượng tá dược rã là 20mg/viên và 30mg/viên trong các công thức CT3, CT4, CT5, CT6, CT7, CT8 làm cho viên rã nhanh hơn. Sự khác biệt về thời gian rã của CT1, CT2 với thời gian rã của các công thức từ CT3 đến CT8 là có ý nghĩa thống kê (p <0,05). Sự khác biệt về thời gian rã giữa công thức từ CT3 đến CT8 là không có ý nghĩa thống kê (p>0,05).
Kết quả trên cũng cho thấy, ở các công thức CT3, CT5, CT6 dùng cùng lượng tá dược rã là 20mg/viên và các công thức CT4, CT7, CT8 có cùng lượng tá dược rã là 30mg/viên nhưng chỉ khác nhau về lượng aerosil, lactose phun sấy, nhưng các công thức này có thời gian rã tương đương nhau. Do đó độ rã của viên ít chịu bị ảnh hưởng bởi aerosil và lactose phun sấy.
* Kết quả ảnh hưởng của thành phần công thức đến khả năng hút ẩm của các công thức khảo sát
Tính hút ẩm của các công thức được đánh giá thông qua việc xác định hàm ẩm tại các thời điểm đã trình bày ở phần phương pháp, kết quả thể hiện ở bảng sau.
Bảng 13: Ảnh hưởng của thành phần công thức đến độ ẩm của viên nang theo thời gian
|
Thời gian |
Độ ẩm của các mẫu ở các thời gian khác nhau, n=6 | |||||||
|
CT1 |
CT2 |
CT3 |
CT4 |
CT5 |
CT6 |
CT7 |
CT8 | |
|
0 giờ |
4,51 ± 0,08 |
4,45 ± 0,04 |
4,82 ± 0,11 |
4,23 ± 0,08 |
4,72 ± 0,12 |
4,15 ± 0,05 |
4,82 ± 0,09 |
4,31 ± 0,16 |
|
12 giờ |
9,17 ± 0,18 |
9,33 ± 0,15 |
9,66 ± 0,29 |
9,41 ± 0,26 |
7,31 ± 0,21 |
6,23 ± 0,14 |
6,96 ± 0,12 |
11,33 ± 0,44 |
|
24 giờ |
11,98 ± 0,15 |
12,01 ± 0,17 |
11,39 ± 0,07 |
12,19 ± 0,15 |
9,12 ± 0,16 |
8,34 ± 0,12 |
8,89 ± 0,16 |
Chảy bết |
|
48 giờ |
Chảy bết |
Chảy bết |
Chảy bết |
Chảy bết |
10,91 ± 0,16 |
10,30 ± 0,17 |
10,84 ± 0,09 |
Chảy bết |
Từ kết quả trên thấy:
Tỷ lệ aerosil thêm vào có ảnh hưởng lớn đến khả năng hút ẩm của khối bột trong viên. Công thức CT8 không sử dụng aerosil có tính hút ẩm cao nhất, ở thời điểm ban đầu có độ ẩm từ 4,31%, nhưng sau 12 giờ đã tăng lên 11,33% và 24 giờ đã bị chảy bết. Khi cho aerosil với tỷ lệ 5 mg/viên ở các công thức CT1, CT2, CT3, CT4 cũng đã làm giảm tính hút ẩm của bột, tuy nhiên sau 48 giờ thì khối bột cũng bị đã chảy bết (Vón lại, kết dính với nhau và mầu khối bột sẫm hơn).Ở công thức CT5 và CT7 tỷ lệ aerosil tăng lên là 10 mg/viên và CT6 aerosil thêm vào cao nhất là 15 mg/viên, đã cải thiện đáng kể tính hút ẩm của khối bột trong viên, sau 48 giờ cả 3 công thức đều chưa bị chảy bết, mà chỉ hơi sẫm màu hơn so với ban đầu và độ ẩm của các công thức này từ 10,30% đến 10,91%, ở CT6 cho thêm tỷ lệ aerosil cao nhất thì tính hút ẩm cũng nhỏ nhất.
Như vậy xu hướng hút ẩm của khối bột trong viên càng giảm khi tỷ lệ aerosil cho vào càng tăng, Tuy vậy ở 3 công thức CT5, CT7 cho 10mg aerosil/viên và CT6 là 15mg aerosil/viên thì sự khác biệt về độ ẩm giữa các công thức tại các thời điểm khác nhau là không có ý nghĩa thống kê (p>0,05).
Tên nguyên liệu - Công thức:
Bảng 14: Công thức bào chế viên nang cứng Reglu BG
|
TT |
Thành phần |
Khối lượng (mg) |
|
1 |
Bột cao khô Sinh địa |
400 |
|
2 |
Natri starch glycolat |
30 |
|
3 |
Aerosil |
10 |
|
4 |
Magnesi stearat |
5 |
|
5 |
Lactose |
27,67 |
|
6 |
Tổng cộng khối lượng viên |
472,67 |
4.2. Xây dựng quy trình bào chế viên nang cứng RegluBG
Quy trình bào chế viên nang theo công thức đã xây dựng. Nhóm nghiên cứu tiến hành đánh giá hình thức cảm quan, độ rã, độ đồng đều khối lượng của chế phẩm, định lượng hàm lượng hoạt chất.
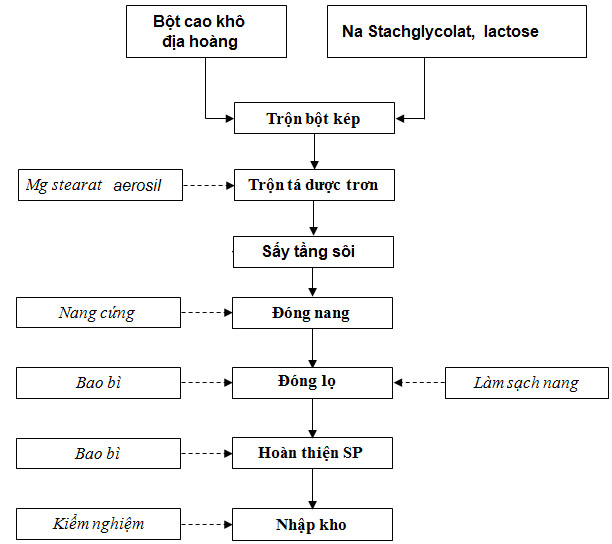
Hình 7. Sơ đồ quy trình bào chế viên nang cứng RegluBG
* Quy trình bào chế:
Chuẩn bị dụng cụ và thiết bị, cân các thành phần công thức chuẩn. Trộn bột kép: Trộn bột dược chất với Aerosil trước, sau đó với Natri Starch glycolat, Lactose phun sấy, với Magnesi stearat sau cùng theo nguyên tắc đồng lượng. Khối bột được sát qua rây 0,355 mm. Đóng khối bột vào nang trên máy đóng nang thủ công. Làm sạch nang, lựa chọn nang đạt tiêu chuẩn. Đóng nang vào lọ. In nhãn, đóng lọ vào hộp. Bảo quản chế phẩm dưới 300C, nơi khô mát, tránh ánh sáng trực tiếp.
* Kết quả đánh giá một số chỉ tiêu chất lượng của viên nang cứng RegluBG
Sau khi bào chế viên nang Reglu BG theo công thức CT7 chuẩn nhóm nghiên cứu đánh giá một số tiêu chuẩn chất lượng có kết quả sau:
Kết quả đánh giá hình thức cảm quan: Viên nang cứng RegluBG có màu nâu cam bạc, sạch bóng, bên trong có chứa bột thuốc khô tơi, màu vàng, mùi thơm, vị hơi ngọt, không có mùi lạ.
Kết quả đánh giá độ rã của viên nang cứng RegluBG: Kết quả đánh giá thời gian rã của viên trong bảng sau:
Bảng 15: Kết quả thử độ rã của viên nang cứng RegluBG
|
Mẫu |
1 |
2 |
3 |
4 |
5 |
6 |
|
Thời gian rã (phút) |
4,8 |
4,2 |
4,5 |
4,0 |
4,3 |
4,9 |
|
TB ± SD |
4,5± 0,4 | |||||
Sau khi thử độ rã của 6 viên nang cứng Reglu BG trên thiết bị đo độ rã thì cả 6 viên đều đạt tiêu chuẩn về độ rã (thời gian rã của 6 viên đều <30 phút). Như vậy, viên nang cứng Reglu BG đáp ứng được yêu cầu về độ rã theo quy định chung của các chế phẩm viên nang của DĐVN IV.
Kết quả đánh giá độ đồng đều khối lượng của viên nang cứng RegluBG:
Sau khi thử độ đồng đều khối lượng với 20 viên nang Reglu BG thu được kết quả sau thể hiện ở bảng sau:
Bảng 16: Kết quả đánh giá độ đồng đều khối lượng của viên nang cứng RegluBG
|
Viên |
Khối lượng (mg) |
Viên |
Khối lượng (mg) |
Viên |
Khối lượng (mg) |
|
1 |
471,98 |
8 |
477,23 |
15 |
473,14 |
|
2 |
482,34 |
9 |
473,49 |
16 |
479,83 |
|
3 |
460,68 |
10 |
454,67 |
17 |
468,73 |
|
4 |
490,28 |
11 |
458,97 |
18 |
470,34 |
|
5 |
472,53 |
12 |
490,18 |
19 |
486,14 |
|
6 |
455,94 |
13 |
472,24 |
20 |
470,91 |
|
7 |
489,63 |
14 |
454,95 |
|
|
|
|
TB ± SD |
|
472,71 ± 11,53 | ||
Từ bảng trên cho thấy khối lượng trung bình của bột thuốc trong viên là 472,71 ± 11,53 và đều trong giới hạn qui định theo yêu cầu của DĐVN IV.
Như vậy, độ đồng đều khối lượng của viên nang cứng Reglu BG đạt yêu cầu quy định chung đối với chế phẩm viên nang cứng theo DĐVN IV.
Kết quả đánh giá mất khối lượng do làm khô của viên nang cứng RegluBG:
Kết quả đánh giá mất khối lượng do làm khô của viên nang cứng Reglu BG được thể hiện ở bảng sau:
Bảng 17: Kết quả đánh giá mất khối lượng do làm khô của viên nang cứng RegluBG
|
Mẫu |
1 |
2 |
3 |
4 |
5 |
6 |
|
KL trước sấy (g) |
1,1204 |
1,1156 |
1,0893 |
1,2048 |
1,1321 |
1,0448 |
|
KL sau sấy (g) |
1,0696 |
1,0657 |
1,0369 |
1,1500 |
1,0773 |
0,9948 |
|
Độ ẩm (%) |
4,53 |
4,47 |
4,81 |
4,55 |
4,84 |
4,79 |
|
TB ± SD |
4,67 ± 0,17 | |||||
Kết quả bảng trên cho thấy chỉ tiêu mất khối lượng do làm khô của viên nang cứng Reglu BG đạt 4,67 ± 0,17 (%) <9%, đạt yêu cầu theo quy định của DĐVN IV.
Kết quả định lượng Catalpol của viên nang cứng Reglu BG: Hàm lượng Catalpol trong viên nang cứng Reglu BG cũng được xác định bằng phương pháp HPLC, kết quả thu được ở bảng sau:
Kết quả định lượng Catalpol của viên nang cứng Reglu BG: Hàm lượng Catalpol trong viên nang cứng Reglu BG cũng được xác định bằng phương pháp HPLC, kết quả thu được ở bảng sau:
Bảng 18: Hàm lượng Catalpol của viên nang cứng Reglu BG
|
Mẫu |
1 |
2 |
3 |
4 |
5 |
6 |
|
HL Catal (mg/viên) |
1,77 |
1,72 |
1,75 |
1,89 |
1,71 |
1,82 |
|
TB ± SD |
1,78 ±0,07 | |||||
Kết quả bảng trên cho thấy hàm lượng Catalpol trong viên nang cứng Reglu BG đạt 1,78 ±0,07 (mg/viên).
Tiến hành sản xuất 5 mẻ cho các nghiên cứu thử, 5 mẻ cho các nghiên cứu tiếp theo, mỗi mẻ 1000 viên nang. Tổng số lượng viên nang cứng là 10.000 viên.
* Kết quả xây dựng được chất lượng thành phẩm như sau:
Tính chất: Viên nang cứng bên trong chứa bột thực phẩm chức năng màu vàng nâu, đồng nhất, mùi thơm đặc trưng của dược liệu, vị ngọt hơi đắng.
Độ rã: Không quá 30 phút.
Độ đồng đều khối lượng: Khối lượng trung bình thực phẩm chức năng trong nang ± 5%.
Mất khối lượng do làm khô: Không quá 9,0%.
Định tính: Định tính catalpol bằng phương pháp HPLC.
Trong phần định lượng, trên sắc ký đồ của mẫu thử phải có píc của catalpol có thời gian lưu trùng với sắc kỳ đồ của dung dịch catalpol chuẩn.
Định lượng: Hàm lượng catalpol trong mỗi viên không được dưới 1,2mg tính theo khối lượng trung bình thực phẩm chức năng trong viên.
Độ nhiễm khuẩn: Phải đạt yêu cầu mức 4, phụ lục 13.6, DĐVN IV.
5. ĐÁNH GIÁ ĐỘ ỔN ĐỊNH CỦA VIÊN NANG CỨNG REGLUBG.
Sau 12 tháng đánh giá độ ổn định ở điều kiện bình thường, không thấy các thay đổi bất thường về tính chất hóa lý của sản phẩm và các chỉ tiêu chất lượng của chế phẩm ở lô 3 vẫn đạt đúng theo tiêu chuẩn cơ sở của chế phẩm. Nghĩa là chế phẩm ổn định ít nhất trong 12 tháng khi bảo quản ở điều kiện thường.
6. ĐÁNH GIÁ ĐỘC TÍNH CẤP CỦA CHẾ PHẨM VIÊN NANG CỨNG
Đánh giá được bước đầu độc tính cấp của chế phẩm viên nang cứng RegluBG.
Viên nang cứng RegluBG do Học viện Quân y nghiên cứu đạt tiêu chuẩn cơ sở. Đã được thử nghiệm trên chuột nhắt trắng chủng Swiss, cả hai giống, khỏe mạnh, trọng lượng 20,0 ± 2,0g do Học viện Quân y cung cấp. Tiến hành theo hướng dẫn của Bộ Y tế, OECD và WHO về xác định độ an toàn cho các chế phẩm có nguồn gốc thiên nhiên [8], 16], [17].
Chuột nhắt trắng trọng lượng 20,0 ± 2,0g, đủ tiêu chuẩn thí nghiệm, được chia ngẫu nhiên thành các lô, mỗi lô 12 con.
Cho chuột uống viên nang cứng RegluBG với các mức liều tăng dần. Trước khi cho uống thực phẩm chức năng, chuột bị bỏ đói trong 16 giờ. Trong số các mức liều đem thử, khoảng cách giữa mức liều cao nhất chưa gây chết một con chuột nào và mức liều thấp nhất gây chết 100% số chuột, cùng số chuột chết trong mỗi lô ở các mức liều nằm trong khoảng cách này được sử dụng để tính toán.
Chuột được nuôi dưỡng chu đáo và theo dõi tình trạng chung về tập tính vận động, ăn uống, lông, da, niêm mạc, chất tiết…và xác định tỷ lệ chuột chết trong 72h của từng lô sau uống thực phẩm chức năng. Sau đó chuột được tiếp tục theo dõi cho đến hết thời gian 7 ngày. Tiến hành phân tích quan sát tình trạng các tạng nếu có chuột chết và tất cả các chuột còn sống sau khi kết thúc thí nghiệm để xác định nguyên nhân gây độc.
7. ĐÁNH GIÁ TÁC DỤNG HỖ TRỢ HẠ ĐƯỜNG HUYẾT CỦA VIÊN NANG CỨNG
Đánh giá được tác dụng hạ đường huyết của viên nang cứng RegluBG để đưa ra các minh chứng về tác dụng của chế phẩm. Thực phẩm chức năng RegluBG do Trung tâm đào tạo và nghiên cứu Dược – Học viện Quân y bào chế và cung cấp, đạt tiêu chuẩn cơ sở. Thực phẩm chức năng tham chiếu Tolbutamib.
Qua nghiên cứu tác dụng hỗ trợ hạ đường huyết trên thỏ đưa ra kết luận sau: Thực phẩm chức năng nghiên cứu có tác dụng hỗ trợ tốt trên mô hình gây đái tháo đường typ 2 ở thỏ, gợi ý cho tác dụng hỗ trợ của thực phẩm chức năng trên đái tháo đường týp 2. Qua nghiên cứu tác dụng hỗ trợ hạ đường huyết trên chuột nhắt trắng: Khẳng định được rằng thực phẩm chức năng viên nang cứng RegluBG có tác dụng hỗ trợ hạ đường huyết trên chuột nhắt trắng bình thường sau 2 đến 4 giờ uống thực phẩm chức năng và tác dụng mạnh nhất ở thời điểm sau 4 giờ uống thực phẩm chức năng. Trên chuột nhắt trắng gây tăng đường huyết bằng STZ tiêm phúc mạc 150mg/kg, RegluBG với các mức liều 680mg/kg/24h và 1360mg/kg/24h uống trong 5 ngày có tác dụng hỗ trợ hạ đường huyết tốt, tương đương với tolbutamid liều 50mg/kg/24h. Tác dụng hỗ trợ hạ glucose huyết của viên nang cứng RegluBG tăng khi mức liều tăng, tuy nhiên sự khác biệt chưa có ý nghĩa thống kê.
e) Thời gian thực hiện: Tháng 01 năm 2014 đến tháng 06 năm 2015
g) Kinh phí thực hiện: 420.562.000 (Ngân sách SNKH: 345.214.000; đối ứng: 75.348.000)./.












